Ostéogenèse imparfaite, Synthèse HAS 2016
Synthèse à destination du médecin traitant
Date de validation
décembre 2016
L’objectif de ce protocole national de diagnostic et de soins (PNDS) est d’expliciter aux professionnels concernés la prise en charge diagnostique et thérapeutique optimale actuelle et le parcours de soins d’un patient atteint d’ostéogenèse imparfaite.
http://www.has-sante.fr/portail/jcms/c_2734084/fr/osteogenese-imparfaite
- L’ostéogenèse imparfaite (OI), ou maladie des os de verre, est une affection rare caractérisée par une fragilité osseuse et une ostéopénie. Elle associe des signes squelettiques de sévérité variable (essentiellement des fractures faciles, une hyperlaxité ligamentaire et des déformations), et des signes extra-squelettiques inconstants (sclérotiques bleutées, surdité, fragilité vasculaire). Elle peut également comporter une dentinogenèse imparfaite. Il existe une grande variabilité d’expression, allant des formes modérées pouvant passer inaperçues à des formes majeures létales périnatales (voir classification en annexe 1).
- La prévalence à la naissance de l’ostéogenèse imparfaite est d’environ 1 pour 10 000 personnes.
- Il s’agit d’une affection génétique. Dans environ 90 % des cas, il s’agit d’une affection autosomique dominante, due à des mutations monoallèliques des gènes COL1A1, COL1A2 ou
IFITM5. Dans 10 % des cas, il s’agit de formes récessives, essentiellement autosomiques, associées à des mutations biallèliques de gènes codant des protéines impliquées dans la synthèse, la maturation ou des modifications post-traductionnelles du collagène de type 1 (COL1A1 et COL1A2) (14 gènes différents connus en septembre 2016 : P3H1, CRTAP, PPIB, FKBP10, SERPINH1, SP7, SERPINF1, BMP1, TMEM38B, WNT1, CREB3L1, TAPT1, PLOD2 et SPARC). Les formes récessives liées à l’X sont à ce jour très rares (PLS3 et MBTPS2)
– cf. annexe 1. Les formes de transmission autosomique récessive sont en règle générale de gravité intermédiaire à sévère. La consultation de génétique est essentielle pour informer sur la maladie, les méthodes de diagnostic, le conseil génétique et les grands principes de prise en charge.
- Le diagnostic doit être évoqué devant des fractures répétées survenant dans des contextes de traumatismes modérés. La majorité des cas sont suspectés pendant l’enfance par l’orthopédiste, le pédiatre ou le médecin généraliste ; chez le nourrisson, le principal diagnostic différentiel est celui de maltraitance. La suspicion d’une ostéogenèse imparfaite doit conduire à orienter le patient et sa famille vers un centre de référence/compétences (CR/CC) pour les maladies osseuses constitutionnelles (MOC) afin de confirmer le diagnostic et mettre en place les mesures de prise en charge adaptées. Le diagnostic repose sur un faisceau d’arguments cliniques et paracliniques. A ce jour, l’étude moléculaire n’est pas indiquée dans un but diagnostique.
- Le patient est pris en charge par une équipe pluridisciplinaire spécialisée, coordonnée par un des CR/CC impliqués dans la prise en charge de cette pathologie, sur le plan régional. La prise en charge de cette affection est orthopédique (prise en charge des fractures et des éventuelles déformations des membres et/ou du rachis), de médecine physique et de réadaptation (rééducation adaptée, réadaptation en vue d’une insertion sociale et scolaire optimale, activité physique adaptée), pédiatrique (traitement des douleurs chroniques et/ou post-fracturaires, traitement éventuel par bisphosphonates), ORL (surdité) et odonto-stomatologique (en cas de dentinogenèse imparfaite) et/ou orthodontique. Ce suivi régulier est assuré par un médecin hospitalier spécialisé dans la prise en charge de cette maladie (pédiatre, généticien, médecin de médecine physique et de réadaptation, orthopédiste, rhumatologue), en lien avec le médecin traitant.
- Le médecin traitant (pédiatre et/ou médecin généraliste) :
- surveille la croissance staturale et pondérale (incluant l’indice de masse corporelle (IMC)) ;
- surveille l’adhésion au traitement et s’assure de sa compréhension auprès de la famille ;
- dépiste des changements dans l’évolution du patient (survenue de douleurs, infléchissement statural, augmentation de la fréquence des fractures) et en informe le CR/CC.
- L’accompagnement socio-éducatif est fondamental pour permettre une inclusion adaptée en crèche, à l’école, dans les activités sportives puis dans la vie professionnelle.
- Les patients doivent être informés de l’existence d’une association de patients (Association de l’Ostéogenèse Imparfaite – AOI, aoi.asso.fr).
- Autres informations utiles :
- Informations générales : Orphanet http://www.orpha.net/consor/cgi-bin/index.php?lng=FR
- Centre de référence maladies osseuses constitutionnelles : http://crmoc.aphp.fr, e-mail : moc.nck@aphp.fr (cf. annexe 2)
- Site OSCAR : http://www.filiere-oscar.fr/
- Site internet : http://www.tousalecole.fr.
- Objectifs du protocole national de diagnostic et de soins
L’objectif de ce protocole national de diagnostic et de soins (PNDS) est d’expliciter aux professionnels concernés la prise en charge diagnostique et thérapeutique optimale actuelle et le parcours de soins d’un patient atteint d’ostéogenèse imparfaite.
Ce PNDS peut servir de référence au médecin traitant (médecin désigné par le patient auprès de la Caisse d’assurance maladie) en concertation avec le médecin spécialiste notamment au moment d’établir le protocole de soins conjointement avec le médecin conseil et le patient, dans le cas d’une demande d’exonération du ticket modérateur au titre d’une affection hors liste.
Le PNDS a pour but d’optimiser et d’harmoniser la prise en charge et le suivi de la maladie afin d’améliorer la qualité de vie des patients et de leur entourage.
Le PNDS ne peut cependant pas envisager tous les cas spécifiques, toutes les comorbidités, toutes les particularités thérapeutiques, protocoles de soins hospitaliers, etc. Il ne peut pas revendiquer l’exhaustivité des conduites de prise en charge possibles, ni se substituer à la responsabilité individuelle du médecin vis-à-vis de son patient. Ce protocole reflète cependant la structure essentielle de prise en charge d’un patient atteint d’ostéogenèse imparfaite. Il doit être mis à jour en fonction des données nouvelles validées.
- Méthode d’élaboration
Le présent PNDS a été établi selon la « Méthode d’élaboration d’un protocole national de diagnostic et de soins pour les maladies rares »
publiée par la Haute Autorité de Santé en 2012 (guide méthodologique disponible sur le site de la HAS : www.has-sante.fr). Elle figure en annexe 3.
Un document plus détaillé ayant servi de base à l’élaboration du PNDS et comportant notamment l’analyse des données bibliographiques identifiées (argumentaire scientifique) est disponible sur le site internet du centre de référence (http://crmoc.aphp.fr).
L’élaboration de ce PNDS n’a bénéficié d’aucun financement spécifique.
- Evaluation initiale
3.1 Objectifs
- Confirmer le diagnostic d’ostéogenèse imparfaite.
- Evaluer son type/sa sévérité.
- Annoncer le diagnostic et informer le patient et/ou les parents sur la maladie et sa transmission et sur l’existence d’une association de patients.
- Evaluer l’éventuel retentissement familial, scolaire ou socioprofessionnel.
3.2 Professionnels impliqués
Le diagnostic est généralement évoqué par l’orthopédiste, le pédiatre ou le médecin généraliste. Il peut également résulter d’une enquête familiale ou être évoqué en anténatal par le gynécologue-obstétricien ou l’échographiste.
Le diagnostic est confirmé par un médecin spécialisé dans les maladies osseuses constitutionnelles (MOC) (pédiatre, généticien, médecin de médecine physique et de réadaptation, orthopédiste, rhumatologue), en centre de référence ou centre de compétences. Ce médecin doit organiser la prise en charge multidisciplinaire du patient en faisant également intervenir d’autres professionnels du secteur sanitaire ou médico-social (psychologue, masseur-kinésithérapeute, ergothérapeute, assistante sociale).
- Suspicion du diagnostic / circonstances de découverte
Le diagnostic d’ostéogenèse imparfaite repose actuellement sur un faisceau d’arguments cliniques et para-cliniques.
Le diagnostic est en général évoqué cliniquement devant l’association de fractures répétées survenues pour des traumatismes modérés à des signes mineurs, inconstants d’un patient à un autre :
- sclérotiques bleutées/grisâtres (aspect bleu-gris de la sclère oculaire, présent chez 80 % des personnes) ;
- hyperlaxité ligamentaire ;
- déformations : protrusion thoracique sternale antérieure ou plus rarement pectus carinatum (thorax en carène), thorax postérieur cyphotique par tassements vertébraux, scoliose, incurvations des membres inférieurs, déformations des membres supérieurs en lame de sabre pour les formes sévères ;
- insuffisance staturale relative ;
- surdité plus ou moins sévère (exceptionnelle chez l’enfant, présente chez environ 40 % des adultes) ;
- peau transparente et hématomes faciles ;
- dentinogenèse imparfaite, se traduisant par des dents translucides, jaunâtres ;
- anomalies cardiaques valvulaires (rares).
Ces arguments seront renforcés par la présence de mêmes symptômes chez un apparenté au premier degré (parent, frère, sœur).
3.4 Confirmation du diagnostic / diagnostic différentiel
Certains examens complémentaires vont permettre d’apporter des arguments diagnostiques significatifs :
- le bilan radiologique est orienté par la clinique. Il comporte au minimum des radiographies du crâne (face et profil) et du rachis dorsolombaire de profil. Des radiographies complémentaires (os longs de face, gril costal) peuvent être nécessaires, notamment chez le nourrisson. Le bilan recherchera :
- des séquelles de fractures, des appositions périostées sur les os longs ;
- des corticales amincies et une transparence osseuse excessive ;
- un crâne souvent court et élargi transversalement ;
- des os wormiens en nombre anormalement élevé (os surnuméraires entre les divers os du crâne) ;
- des déformations osseuses (incurvations des os longs, saillie du sternum, gracilité progressive du squelette, élargissements métaphysaires en bulbe d’oignon) ;
- une protrusion acétabulaire ;
- une impression basilaire (translocation vers le haut de la partie supérieure de la colonne cervicale et du clivus dans le foramen magnum) ;
- la densitométrie osseuse : elle montre une diminution de la densité minérale osseuse (DMO) corrélée au sexe et à l’âge (on considère le Z-score chez l’enfant, et le T-score chez l’adulte). Néanmoins, une DMO normale ne permet pas d’éliminer le diagnostic. Il existe des normes publiées selon les machines à partir de 3 ans ou 5 ans. La réalisation de cet examen est difficile chez le très jeune enfant ;
- le bilan phosphocalcique : il est normal, ce qui permet d’exclure d’autres causes d’ostéopathies fragilisantes
(notamment hypophosphatasie, rachitismes métaboliques, maladie de Paget).
Il n’y a pas d’élément clinique ou para-clinique unique permettant d’affirmer à lui seul et avec certitude le diagnostic d’ostéogenèse imparfaite.
Les principaux diagnostics différentiels à discuter selon le bilan clinique et para-clinique sont :
- le syndrome de Bruck
- le syndrome d’Ehlers-Danlos type progéroïde
- la dysplasie cléido-crânienne
- l’ostéoporose liée à l’X
- l’ostéoporose primitive (+/- familiale)
- l’ostéoporose idiopathique juvénile
- le syndrome ostéoporose-pseudogliome
- le syndrome de Cole-Carpenter
- l’hypophosphatasie
- le syndrome de Stüve-Wiedemann
- la mucolipidose type II
- la mucolipidose type III
- la dysplasie spondylo-oculaire
- la gérodermie ostéodysplasique.
Certains cas conduisent à envisager l’hypothèse de la maltraitance.
Cette situation est difficile pour toutes les personnes impliquées : enfant, parents, équipe médicale, équipe socio-administrative, et intervenants judiciaires éventuellement requis. On rappelle les conséquences potentiellement dramatiques : d’une part, ne pas reconnaître un enfant en situation de danger et, d’autre part, accuser à tort une famille dont le parcours médical (parfois lourd) sera à très long terme empreint de ces accusations erronées. L’enquête peut conclure à la conjonction d’une fragilité osseuse constitutionnelle et de manœuvres intempestives ou de gestes maltraitants.
Des fiches et documents de travail spécifiques à ce sujet sont disponibles sur le site de la HAS : http://www.has-sante.fr/portail/jcms/c_1760393/fr/maltraitance-chez-l-enfant-reperage-et-conduite-a-tenir.
Cette problématique fait aussi l’objet d’un travail spécifique par la filière OSCAR (http://www.filiere-oscar.fr/).
3.5 Consultation de génétique et étude moléculaire
L’étude moléculaire est actuellement réalisée par séquençage haut débit, via des panels NGS (Next Generation Sequencing). Ces panels sont actuellement réalisés dans plusieurs laboratoires de génétique moléculaire spécialisés et habilités dont la liste est disponible sur le site http://www.filiere-oscar.fr/. L’étude peut être complétée si besoin par la recherche de délétion intra-génique par MLPA (Multiplex Ligation-dependent Probe Amplification – amplification multiplex de sondes dépendant d’une ligation).
L’étude moléculaire est relativement longue, et de sensibilité non complète (problème de l’interprétation des variants et des faux-négatifs). Cette étude est néanmoins de plus en plus proposée aux familles afin de connaître leur statut, le gène impliqué et de répondre à la question du conseil génétique. Elle sera particulièrement recommandée :
- aux personnes porteuses d’une forme sévère envisageant un diagnostic prénatal (DPN) ;
- aux parents d’enfants (ou fœtus) ayant une forme sévère et qui souhaitent un DPN lors d’une future grossesse.
Les résultats de cette étude ne modifient la prise en charge que pour les rares formes peu ou moins sensibles aux bisphosphonates (données publiées pour SERPINF1 et IFITM5).
Elle ne peut être effectuée qu’après une consultation de génétique dédiée. Cette consultation comprend l’enquête génétique des apparentés porteurs de l’affection, les explications vis à vis de l’étude moléculaire et les données du conseil génétique.
La grande majorité des ostéogenèses imparfaites est de transmission de type autosomique dominant. Elles sont associées à un risque de transmission de 50 % pour la descendance d’un patient atteint ; en revanche, le risque de récurrence chez des parents indemnes ayant un premier enfant atteint est de l’ordre de 5 % (mosaïque germinale).
Plus rarement, la transmission est autosomique récessive ; ces formes sont associées à un risque de récurrence de 25 % pour des parents ayant déjà un enfant porteur de la pathologie. Les formes exceptionnelles liées à l’X sont en général symptomatiques chez les garçons, avec parfois des signes mineurs chez leur mère porteuse de la mutation. Le conseil génétique est alors rassurant pour les enfants de sexe masculin d’un homme atteint. Ses filles seront porteuses saines ou pauci-symptomatiques. La consultation de génétique spécialisée permet d’accompagner les familles dans leur choix et
éventuellement de discuter des moyens de diagnostic prénatal, et des techniques de diagnostic préimplantatoire.
3.6 Annonce du diagnostic
L’annonce du diagnostic doit faire l’objet d’une consultation à part entière. Elle doit être effectuée par un médecin expérimenté dans la prise en charge de l’OI, aux deux parents, en abordant :
- les principales manifestations de cette affection et sa variabilité clinique ;
- son origine génétique, les indications de l’étude moléculaire ;
- les grandes lignes de la prise en charge médico-chirurgicale ;
- l’organisation du suivi, notamment le rythme des consultations et les médecins référents ;
- les règles de vie au quotidien permettant de limiter le risque de fracture ;
- l’accueil en collectivité (crèche, école) possible dans la majorité des cas (cf. ci-dessous) ; les éventuelles adaptations dans le monde professionnel ;
- les démarches administratives dans le cadre de la prise en charge médico-sociale.
Cette annonce doit parfois être faite progressivement (notamment dans les formes sévères) et souvent en plusieurs étapes. Un accompagnement psychologique peut être proposé lors de l’annonce ou par la suite, lors de phases ressenties difficiles. Cet accompagnement doit être proposé à l’enfant, à ses parents et à la fratrie, et relayé au niveau des intervenants de proximité (voir chapitre 4.15).
Les patients et leurs familles doivent être informés sur l’existence de l’association de patients (Association de l’Ostéogenèse Imparfaite – AOI, www.aoi.asso.fr).
3.7 Evaluation de la sévérité de la maladie
Le bilan initial est adapté à l’âge, aux circonstances diagnostiques et au degré de sévérité clinique.
En plus du bilan radiographique initial, il peut être complété par des radiographies du rachis cervical (dans les formes sévères), des membres supérieurs et inférieurs de face en cas d’antécédent de fractures des os longs ou si incurvation apparente.
La densitométrie osseuse n’est utile que dans les formes douteuses pour apporter un argument supplémentaire, ou en bilan pré-thérapeutique en vue d’un traitement par bisphosphonates1.
Sont également appréciés :
- l’état général ;
- la courbe de croissance staturo-pondérale et celle du périmètre crânien ; l’IMC ; la taille allongée et en position assise en cas de scoliose ou de station debout impossible ;
1 Haute Autorité de Santé, 2006, « Ostéodensitométrie sur 2 sites par méthode biphotonique ». « La mesure de la DMO par DXA sur 2 sites peut être proposée pour participer au diagnostic et
à l’évaluation de la maladie, chez l’adulte ou l’enfant, afin de mettre en place au plus vite une prise en charge adaptée (fonctionnelle, médicamenteuse, conseil génétique) : 4 études (n = 70, enfants et adultes) ont montré que la DMO lombaire +/- fémorale était plus faible chez les patients atteints d’OI que chez les sujets non atteints.
En cas de suspicion de maltraitance chez des enfants présentant des fractures multiples, une
DMO normale pour l’âge et le sexe ne permettra pas d’éliminer totalement le diagnostic d’OI, notamment en cas d’OI modérée de type I (1 étude, n = 63) ; à l’inverse, une DMO diminuée ne permettra pas à elle seule d’affirmer le diagnostic d’OI et d’éliminer une maltraitance (avis d’expert).
Le choix de l’ostéodensitométrie sur 2 sites ou corps entier va dépendre, entre autres, des antécédents de fractures ou déformations ; l’ostéodensitométrie corps entier sera préférée en cas de fractures vertébrales ou périphériques multiples.
Par ailleurs, les difficultés de réalisation et d’interprétation de l’ostéodensitométrie chez l’enfant devraient la réserver à des centres spécialisés dans la prise en charge des ostéopathies de l’enfant. »
- l’état fonctionnel : périmètre de marche, limitations articulaires, syndromes douloureux, hyperlaxité ;
- l’état dentaire ;
- l’état respiratoire (explorations fonctionnelles respiratoires dans les formes avec déformation thoracique et/ou insuffisance staturale ; fait partie du bilan avant traitement par bisphosphonates) ;
- l’acuité auditive ;
- l’auscultation cardiaque ;
- le mode de vie (activités sociales, scolaires ou professionnelles, sportives), conditions de vie (accessibilité de l’habitat) et qualité de vie.
- Prise en charge thérapeutique
4.1 Préambule
Plusieurs spécialités pharmaceutiques mentionnées dans ce PNDS pour la prise en charge thérapeutique de l’enfant sont utilisées dans une indication ou des conditions d’utilisation non prévues dans l’autorisation de mise sur le marché (AMM).
Il est rappelé que :
- la prescription de la spécialité est possible2, en l’absence d’alternative médicamenteuse appropriée, si l’indication (ou les conditions d’utilisation) a (ont) fait l’objet d’une recommandation temporaire d’utilisation (RTU) ou si le prescripteur juge indispensable, au regard des données acquises de la science, le recours à cette spécialité pour améliorer ou stabiliser l’état clinique du patient. Dans ce cas :
- le patient doit être informé du caractère hors AMM de la prescription, « de l’absence d’alternative médicamenteuse appropriée », « des risques encourus et des contraintes et bénéfices susceptibles d’être apportés par le médicament », des conditions de prise en charge par l’assurance maladie ;
- la mention « Prescription hors autorisation de mise sur le marché » doit figurer sur l’ordonnance ;
2 Article L. 5121-12-1 du code de la santé publique
- la prescription doit être motivée dans le dossier médical du patient ;
- l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) peut s’appuyer sur le PNDS pour élaborer une RTU de la spécialité dans l’indication hors AMM, s’il n’existe pas d’alternative médicamenteuse appropriée3 ;
- la spécialité peut faire l’objet d’une prise en charge ou d’un remboursement par l’assurance maladie dans l’indication hors AMM, à titre dérogatoire et pour une durée limitée, après avis de la HAS, à condition qu’elle ait fait l’objet au préalable d’une RTU et que son utilisation soit indispensable à l’amélioration de l’état de santé du patient ou pour éviter sa dégradation4.
4.2 Objectifs
- réduire le nombre de fractures et leurs complications, maintenir une mobilité optimale et prendre en charge la douleur ;
- optimiser la croissance et la taille adulte ;
- diagnostiquer et prendre en charge les complications et comorbidités de la maladie, en particulier la surdité, les complications dentaires et l’éventuelle atteinte cardiaque ;
- optimiser la prise en charge des fractures par la famille et les structures d’urgence par la formation et l’éducation ;
- améliorer la qualité de vie des patients et des familles à tous les âges ;
- optimiser l’intégration sociale, scolaire et professionnelle.
La prise en charge concerne toutes les formes d’OI, quelle que soit leur origine génétique. Un schéma de suivi multidisciplinaire sera décliné en fonction de la gravité de la maladie et des symptômes présentés par le patient.
4.3 Professionnels impliqués
Le patient est pris en charge par une équipe pluridisciplinaire spécialisée coordonnée par le centre de référence/compétences où il sera adressé.
- Article L. 5121-12-1 du code de la santé publique
La prise en charge de cette affection pendant la période pédiatrique est essentiellement organisée autour du pivot central : orthopédiste (prise en charge des fractures et des éventuelles déformations de l’axe rachidien et des membres), pédiatre hospitalier et/ou endocrinopédiatre (traitement des douleurs chroniques et/ou post-fracturaires, traitement par bisphosphonates), médecin de médecine physique et de réadaptation (rééducation, adaptations), et généticien.
De nombreux professionnels concourent à la prise en charge globale des patients :
- autres professionnels de santé hospitaliers spécialistes intervenant dans le diagnostic et la prise en charge des OI : anesthésistes et médecins spécialistes de la douleur, médecins ORL, pneumologues, rhumatologues, radiologues, cardiologues, neurochirurgiens, chirurgiens-dentistes, stomatologistes, chirurgiens maxillo-faciaux, chirurgiens plasticiens, hématologues, gynécologues-obstétriciens, sages-femmes, audioprothésistes.
- médecins généralistes, pédiatres, médecins scolaires, médecins de maison départementale des personnes handicapées (MDPH), médecins conseils ;
- masseurs-kinésithérapeutes, orthoprothésistes et prothésistes dentaires, ergothérapeutes ;
- psychologues ;
- assistantes sociales.
- Prise en charge thérapeutique initiale et éducation thérapeutique
- Initier l’éducation thérapeutique du patient et/ou de son entourage
- Des mesures de précaution doivent être enseignées aux parents (des documents concernant certaines de ces mesures sont
disponibles via l’association AOI et sur le site OSCAR, http://www.filiere-oscar.fr/) :
- apprendre la mobilisation adéquate d’un bébé fragile avec maintien de l’axe rachidien, éviter les manœuvres intempestives ;
- habillage avec des vêtements amples de fermeture antérieure ;
- adaptation du domicile avec l’aide d’un ergothérapeute pour les formes sévères ;
- éviter les traumatismes et certaines activités (trampoline, toboggan, sports collectifs violents) ;
- prendre en compte toute douleur inhabituelle et détecter un syndrome douloureux chronique.
- La mise en collectivité des nourrissons et la scolarisation ne sont pas contre-indiquées dans la majorité des cas ; dans les formes modérées et moyennes, elles doivent être accompagnées et dédramatisées. Elles peuvent être difficiles dans les formes sévères. Des documents permettant l’élaboration d’un projet d’accueil individualisé (PAI) sont délivrés par les établissements scolaires et remplis par l’équipe pédagogique, le médecin scolaire, les parents et le médecin référent.
- La conduite à tenir en cas de fracture doit être apprise aux parents très précocement. Elle fait l’objet d’une fiche disponible auprès de l’AOI et d’une vidéo spécifique « Immobilisation ʺmaisonʺ d’une fracture de l’enfant ayant une fragilité osseuse »
parmi les « Tutos d’OSCAR »
(https://www.youtube.com/channel/UCz1PsLVv7-YJd_HjxNq4xZQ).
- Planifier la prise en charge thérapeutique, le suivi général et l’accompagnement psychologique familial
- Expliquer les modalités de la prise en charge et du suivi (intervenants, fréquence des consultations et des examens complémentaires, traitements indiqués) ;
- Remettre à la famille et/ou au patient les documents (carte de soins et d’urgence, disponible auprès du centre de référence et de l’Association de l’Ostéogenèse Imparfaite) et les numéros de téléphone utiles ;
- Si enfant en âge scolaire, il faut préparer l’accueil à l’école avec l’équipe pédagogique qui mettra en place les adaptations nécessaires en concertation avec le médecin référent [voir sur le site Tous à l’école la fiche Fragilité osseuse/Ostéogenèse imparfaite/BEP (besoins éducatifs particuliers), http://www.tousalecole.fr/content/fragilit%C3%A9-osseuse-ost%C3%A9ogen%C3%A8se-imparfaite-bep].
- Prise en charge des fractures, chez l’enfant et l’adulte, au domicile et dans les lieux de vie du patient
La prise en charge est détaillée dans le guide Orphanet urgence (http://www.orpha.net/consor4.01/www/cgi-bin/Disease_Emergency.php?lng=FR&stapage=FICHE_URGENCE_O1)
.
– Antalgiques au domicile
Les familles doivent disposer d’antalgiques adaptés, à administrer par voie orale, rangés en lieu sûr, afin de pouvoir les donner avant le transfert de l’enfant à l’hôpital.
En cas de douleur d’intensité modérée
| · | Paracétamol | (15 mg/kg | toutes | les | 6 heures) | + | ibuprofène | |
| (10 mg/kg toutes les 8 heures – AMM à partir de 3 mois). | ||||||||
| En cas de douleur d’intensité plus forte ou persistante | ||||||||
| · | Si douleur | plus marquée ou | persistante : tramadol | (0,5 à | ||||
| 2 mg/kg/prise selon l’intensité de la douleur, en espaçant les | ||||||||
| prises d’au | moins 4 heures – AMM | chez l’enfant | de | plus de | ||||
| 3 ans). Chez un enfant âgé de 6 mois à 3 ans : morphine solution | ||||||||
| buvable à | 20 mg/ml | toutes | les | 4 heures | (dose | initiale | ||
| 0,1 mg/kg/prise entre 6 mois et 1 an, et 0,2 mg/kg/prise à partir | ||||||||
| de 1 an). | ||||||||
- Si la douleur est soulagée, continuer cet antalgique tant que nécessaire, jusqu’à la prise en charge hospitalière.
En cas de douleur d’emblée très intense
En première intention, le plus rapidement possible, donner :
- Si l’enfant a plus de 3 ans : tramadol (1 à 2 mg/kg/prise selon
intensité de la douleur en espaçant les prises d’au moins
4 heures – AMM chez l’enfant de plus de 3 ans) ; si l’enfant a entre 6 mois et 3 ans : morphine orale (cf. ci-dessus).
- Si la douleur n’est pas soulagée, donner de la morphine (dose de
charge : 0,4 à 0,5 mg/kg, maximum 20 mg – AMM à partir de 6 mois). Elle peut être donnée sans délai après échec du tramadol.
- En principe, après l’immobilisation, la douleur diminue, la morphine est arrêtée et le relai est pris par le paracétamol + ibuprofène.
- Si la douleur reste intense après l’immobilisation, continuer la morphine 0,2 mg/kg toutes les 4 heures jusqu’au transfert hospitalier. Quand la douleur a diminué, passer à paracétamol + tramadol (si enfant de plus de 3 ans).
– Immobilisation (après administration d’antalgiques)
- L’immobilisation est le premier des antalgiques. Elle facilite les déplacements et le transfert éventuel vers un service d’urgences et/ou de radiologie.
- Le matériel d’immobilisation doit toujours être prêt et disponible.
Ce matériel aura été préparé avec une personne qualifiée de l’équipe soignante hospitalière (masseur-kinésithérapeute, médecin de médecine physique et de réadaptation, orthopédiste…).
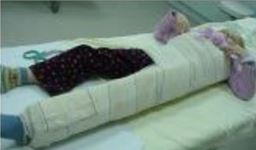
- L’immobilisation sera adaptée à la localisation de la fracture (cf. brochure « Immobilisation maison » en annexe 4).
4.5 Traitements orthopédiques
- Prise en charge hospitalière d’une fracture
– Antalgiques en milieu hospitalier
- En milieu spécialisé, il est possible de recourir :
- au traitement morphinique : intraveineux (0,1 mg/kg [selon la méthode de titration] puis 0,025 mg/kg toutes les 5 minutes jusqu’à obtention d’une analgésie correcte), ou per os (morphine à libération immédiate 0,5 mg/kg, plus ou moins suivie de prises ultérieures à 0,2 mg/kg) ;
- aux blocs nerveux.
- Avant prise de sang : crème anesthésiante.
- Avant toute manipulation (radiographie, plâtre) : mélange oxygène-protoxyde d’azote systématique. Mobiliser le patient avec douceur, notamment lors de l’examen radiologique.
– Immobilisation
- Le matériel d’immobilisation doit être léger (résines).
- La durée d’immobilisation doit être plus courte que chez les patients sans fragilité osseuse. L’ablation précoce du plâtre peut être relayée au niveau des membres inférieurs par une attelle postérieure plâtrée.
- La trophicité musculaire de la zone immobilisée et du reste du corps doit être entretenue afin de limiter le risque d’ostéopénie liée à l’immobilisation (contractions sous plâtre, verticalisation, kinésithérapie après ablation de l’appareillage).
- Ostéosynthèse palliative des membres
L’ostéosynthèse palliative a pour but de protéger une diaphyse fragile, souvent déformée et siège de fractures à répétition. Les ostéosynthèses segmentaires doivent être proscrites en dehors de rares indications (par exemple à l’extrémité supérieure du fémur, associées à une synthèse centromédullaire).
L’enclouage centromédullaire d’une épiphyse à l’autre est la méthode de référence. Différents matériels peuvent être utilisés (broches, clous) avec recherche d’un effet télescopique par amarrage
épiphysaire. Le matériel centromédullaire ne doit pas être trop volumineux.
Les ostéosynthèses centromédullaires sont souvent laissées en place toute la vie, en dehors de complications.
Le choix de la technique chirurgicale, de la voie d’abord (abord à foyer ouvert, abord mini invasif ou percutané, sous amplificateur de brillance) et du matériel utilisé va dépendre du site et du type de fracture ainsi que des habitudes des différentes équipes.
L’immobilisation par plâtre ou résine après ostéosynthèse n’est pas systématique mais la mobilisation est reprise de manière progressive.
Certaines situations nécessitent une prise en charge particulière :
- Coxa vara : fréquente, elle doit être prévenue par une ostéosynthèse fixant le col fémoral en valgus.
- Fracture sur enclouage : souvent sans conséquence, va guérir rapidement par une simple immobilisation. Rarement, elle peut conduire à un changement de matériel.
- Sepsis : peu fréquent, il peut nécessiter une ablation du matériel.
- Formes avec cal hypertrophique (type 5) : il est recommandé d’utiliser des anti-inflammatoires en postopératoire pendant 3 à 4 semaines pour limiter la formation de ces cals hypertrophiques.
Les bisphosphonates doivent être arrêtés au minimum 48 heures avant une chirurgie et ne doivent pas être prescrits pendant les trois mois suivant une chirurgie afin d’éviter un retard de consolidation osseuse.
- Traitement des déviations rachidiennes
La fréquence des déformations rachidiennes varie de 20 à 80 % selon les séries et l’âge des patients. Elles entraînent un handicap important, une diminution de la taille et la restriction des volumes pulmonaires.
- Le traitement orthopédique (corset) est réservé aux formes modérées.
- L’arthrodèse vertèbrale postérieure est de plus en plus utilisée dans l’OI ; elle permet la stabilisation de la déformation rachidienne. Trois critères majeurs influent sur la décision chirurgicale : aggravation de la courbure, dégradation respiratoire, arrêt de la croissance. La traction par un halo péricrânien préopératoire permet une correction progressive de la déformation et une amélioration des capacités respiratoires grâce à la rééducation fonctionnelle.
- Des complications de la charnière cervicale (impression basilaire, instabilité de l’odontoïde, luxation cervicale) sont possibles dans les formes sévères et/ou progressives. Ces complications peuvent être silencieuses ou entraîner des céphalées, des vertiges, des névralgies, des torticolis ou des modifications des réflexes ; dans les cas graves, elles se traduisent par des troubles de déglutition, des paralysies, voire des malaises avec mort subite. Une IRM de la charnière cervicale doit être effectuée dans la première année de vie chez tous les enfants porteurs d’une forme sévère, ou avec une platybasie importante. Cette IRM doit être faite ou refaite en cas de survenue de symptômes décrits plus haut. Le traitement consiste en une immobilisation par minerve et une intervention chirurgicale de réduction de l’impression basilaire avec greffe osseuse.
- Particularités de la prise en charge chez l’adulte
Il est nécessaire d’accompagner les patients lors de la transition de l’âge pédiatrique à l’âge adulte (consultation de transition avec les
équipes adultes et pédiatriques).
En général, il existe une diminution de l’incidence des fractures après la fin de la puberté, avec une certaine stabilisation de la maladie au début de l’âge adulte. Le risque fracturaire réapparaît à l’âge de la ménopause où de nouvelles fractures peuvent survenir. Leur prise en charge orthopédique reste celle des fractures hors OI en réinsistant sur la nécessité d’une immobilisation légère, d’une mobilisation précoce concernant les segments non immobilisés et le membre fracturé.
Les formes sévères, à l’âge adulte, sont marquées par des difficultés rachidiennes croissantes. Les cyphoscolioses peuvent être évolutives, affectant le pronostic fonctionnel, respiratoire et vital. La prise en charge est souvent délicate et peut parfois nécessiter une arthrodèse vertébrale postérieure.
- Prise en charge en médecine physique et de réadaptation
La médecine physique et de réadaptation (MPR) vise à améliorer les capacités fonctionnelles des enfants et adultes atteints d’ostéogenèse imparfaite. Elle est indiquée dans toutes les formes d’ostéogenèse imparfaite et constitue le seul traitement dans les formes peu sévères. Elle associe un travail dans des services de MPR spécialisés et un relai par les masseurs-kinésithérapeutes de proximité.
Les objectifs de rééducation sont :
- prévenir la perte osseuse induite par l’immobilité ;
- renforcer globalement la musculation ;
- optimiser l’indépendance fonctionnelle et assurer autonomie, socialisation et qualité de vie.
Les recommandations de rééducation et réadaptation figurent en annexe 5.
4.7 Traitements par bisphosphonates chez l’enfant
- Objectifs du traitement
- diminuer le nombre de fractures, diminuer le risque de survenue de nouveaux tassements vertébraux chez un enfant qui a déjà un ou plusieurs tassements vertébraux ;
- diminuer les douleurs osseuses chez l’enfant douloureux ;
- augmenter la mobilité lorsqu’elle est limitée.
- Indications
Aucun bisphosphonate n’a d’AMM pour l’enfant porteur d’une OI. La décision d’un traitement par bisphosphonates et de sa place dans la stratégie thérapeutique doit être prise après concertation médico-chirurgicale impliquant orthopédistes, médecins spécialistes des pathologies osseuses, médecins de médecine physique et de réadaptation et endocrinologues.
Les bisphosphonates sont indiqués sur des arguments cliniques et/ou radiologiques (et non pas densitométriques) et sont en particulier discutés en cas de :
- survenue de plus de 3 fractures, vertèbres comprises, pour des traumatismes bénins dans les 2 années précédentes ;
- tassements vertébraux avec ou sans trouble de la statique rachidienne (scoliose ou cyphose) ;
- impression basilaire menaçante, protrusion acétabulaire marquée ; ces signes sont en général associés aux formes sévères avec d’autres critères de mise sous bisphosphonates ;
- dans les formes néonatales d’allure sévère, notamment chez les enfants avec fractures de survenue anté- et périnatale.
Le suivi des enfants traités est clinique, biologique, radiologique et par densitométrie.
Aucune étude ni recommandation ne statue sur l’arrêt du traitement. La progression maximale de la DMO et de l’épaisseur de la corticale a lieu pendant les deux premières années de traitement. Du fait de l’absence de corrélation DMO/risque fracturaire en pédiatrie, certains ont proposé une durée de traitement de 2 à 4 ans selon l’évolution de l’incidence des fractures, de la hauteur vertébrale en cas de tassements vertébraux, de la mobilité, des marqueurs de remodelage osseux et de la densitométrie osseuse.
Dans l’OI sévère, le traitement est poursuivi tout au long de la croissance en diminuant les doses cumulées annuelles, diminution des doses ou espacement des injections en fonction de l’évolution clinique et des marqueurs osseux.
L’utilisation d’un marqueur dynamique du remodelage osseux est en cours d’étude afin de déterminer une dose minimale efficace de bisphosphonate à administrer tout au long de la croissance.
- Posologies et conditions d’utilisation
Les bisphosphonates par voie veineuse semblent plus efficaces chez l’enfant. Sont utilisés essentiellement le pamidronate à la dose moyenne de 9 mg/kg/an (cures tous les 2 à 4 mois selon l’âge de l’enfant – voir annexe 6 –) ou plus récemment l’acide zolédronique à la dose 0,025 à 0,050 mg/kg 2 fois par an.
4.8 Traitement par bisphosphonates chez l’adulte
Chez l’adulte atteint d’OI, il n’y a pas, à ce jour, de consensus sur l’utilisation des bisphosphonates. Les données de la littérature sont discordantes et n’ont pas démontré formellement de bénéfice, quelle que soit la voie d’administration. D’autres traitements anti-ostéoporotiques sont à l’étude.
4.9 Traitement par hormone de croissance chez l’enfant
Les patients atteints d’OI peuvent présenter un retard statural, d’importance variable selon la gravité de la maladie. L’effet de l’hormone de croissance dans l’ostéogenèse imparfaite semble modéré et inconstant. L’hormone de croissance n’est pas indiquée de façon régulière à ce jour dans l’ostéogenèse imparfaite.
4.10 Prise en charge ORL
La surdité est présente chez 22 à 58 % des patients atteints d’ostéogenèse imparfaite. Elle apparaît progressivement et est le plus souvent bilatérale et tardive. Elle se révèle de façon variable, entre 15 et 40 ans. Elle peut être de transmission (par atteinte de l’étrier), de perception ou mixte. Tous les degrés de surdité peuvent être observés.
Un déficit auditif lié à une otite séreuse chez le petit enfant OI semble plus fréquent que dans la population générale.
Il est recommandé que chaque enfant atteint d’OI ait, avant l’âge de 5 ans, un audiogramme. Celui-ci sera répété en moyenne tous les trois ans ou de manière plus rapprochée en cas de perte auditive.
La prise en charge de la surdité est variable selon le type de surdité et sa sévérité ; si la chirurgie est indiquée, elle doit être réalisée par une équipe habituée à la prise en charge des patients atteints d’OI en raison du risque plus élevé de complications (notamment hémorragies).
4.11 Prise en charge odontologique et stomatologique
La dentinogenèse imparfaite constitue la conséquence dentaire de l’ostéogenèse imparfaite, par anomalie du collagène dans la dentine.
Sa fréquence varie de 36 à 65 % (voire 100 % selon certains auteurs). Elle affecte sévèrement les dents temporaires et les dents permanentes, préférentiellement les incisives et les 1res molaires :
- dyschromie, du gris au brun ;
- usure, attritions, voire fractures des dents ;
- modifications morphologiques de la couronne et de la racine.
La sévérité de l’atteinte dentaire n’est pas corrélée à celle de l’atteinte osseuse.
La prise en charge de la dentinogenèse imparfaite peut impliquer les chirurgiens-dentistes, les stomatologistes, les chirurgiens maxillo-faciaux et plasticiens et les prothésistes dentaires. Elle doit se faire au sein ou en lien avec un centre de référence/compétences dédié (listes en annexe 2).
La prise en charge est fonction de l’âge et de la gravité des atteintes osseuses/dentaires.
4.11.1 Prévention des altérations dentaires
Elle comporte :
- l’apprentissage de l’hygiène bucco-dentaire et des conseils diététiques adaptés à l’âge ;
- la fluorothérapie par voie orale et/ou topique (vernis ou gels en gouttières) selon les recommandations en vigueur (« Utilisation du fluor dans la prévention de la carie dentaire avant l’âge de
18 ans », Afssaps, 2008) ;
- des contrôles au moins annuels chez le chirurgien-dentiste. Ces contrôles seront renforcés chez les patients sous bisphosphonates.
4.11.2 Prise en charge dentaire
- Le traitement restaurateur est adapté à la perte de tissu dentaire ou au nombre de dents absentes. Différentes options sont possibles :
- recours à des matériaux de reconstruction (verres ionomères, composites…) ou réalisation d’inlay-onlay ;
- options prothétiques (couronnes, bridges, prothèses conventionnelles ou implanto-portées, implants).
- Le traitement endodontique : en fonction du degré d’atteinte de la pulpe et pour prévenir la survenue de lésion péri-apicale, un traitement endodontique peut être nécessaire. A noter que la dentinogenèse imparfaite est à l’origine d’une oblitération canalaire précoce qui doit être prise en compte.
- Les extractions dentaires sont difficiles en raison d’une tendance à la fracture de la dent hypominéralisée.
- Une prise en charge orthodontique peut être nécessaire comme chez tout enfant et n’est pas contre-indiquée.
Par ailleurs, les caractéristiques cranio-faciales dans l’OI favorisent le développement de dysmorphoses dento-maxillaires induisant des troubles de l’occlusion.
4.12 Autres prises en charge médicales
– Prise en charge respiratoire
Dans les formes moyennes à sévères, marquées par une déformation thoracique, une cyphoscoliose ou un thorax court, il peut y avoir un retentissement sur la capacité respiratoire.
L’évaluation et la prise en charge respiratoires peuvent alors prendre une place très importante, chez l’enfant comme chez l’adulte. Elles doivent comporter :
- la réalisation d’explorations fonctionnelles respiratoires chez tout enfant atteint d’une forme moyenne ou sévère d’OI (à partir de l’âge de 5 ans pour les formes ayant des tassements vertébraux, à répéter tous les 2 à 5 ans selon la gravité) et notamment avant chirurgie du rachis ;
- une polysomnographie en cas de forme sévère et/ou complication au niveau du rachis cervical (adultes, enfants) et en cas de suspicion de syndrome d’apnées hypopnées obstructives du sommeil ;
- une prévention des infections respiratoires (vaccination contre la grippe, éviction des contages, personnes contagieuses et tabagisme) ;
- un traitement antibiotique « facile » en cas d’infection respiratoire d’allure bactérienne ;
- un examen cytobactériologique des crachats en cas de bronchorrhée répétée ou chronique ;
- des techniques d’hyperinsufflation quotidienne, et/ou de ventilation non invasive nocturne selon le résultat des épreuves fonctionnelles respiratoires et de l’exploration du sommeil, instaurées et surveillées par un pneumo-pédiatre ou pneumologue habilité. On s’attachera à choisir une interface la moins traumatisante (embout buccal pour l’hyperinsuffllation et des canules ou embouts narinaires pour la ventilation non invasive).
– Prise en charge cardiovasculaire
Les anomalies cardiovasculaires sont relativement rares dans l’ostéogenèse imparfaite, en général peu sévères, peu évolutives et souvent de découverte fortuite à l’âge adulte. Elles atteignent de façon prépondérente les valves des cavités gauches, la racine de l’aorte et l’aorte descendante. Ces anomalies sont décrites dans tous les types d’ostéogenèse imparfaite. Il n’y a pas de corrélation entre la gravité de l’ostéogenèse imparfaite et le risque de survenue de complications cardiovasculaires.
Il est usuel de recommander une échographie cardiaque chez tout patient ayant une ostéogenèse imparfaite à l’âge de 10 ans. Elle pourra être répétée tous les 2 à 3 ans dans les formes avec hyperlaxité marquée ou en présence de symptômes évocateurs.
Il est important de rechercher une hypertension artérielle pulmonaire sur l’échocardiographie en cas d’insuffisance respiratoire associée (nécessité d’une ventilation non invasive nocturne).
Compte tenu de la fragilité tissulaire et du risque hémorragique, la prise en charge chirurgicale peut être délicate et devra se faire en milieu spécialisé.
– Prise en charge du risque hémorragique
Les patients atteints d’ostéogenèse imparfaite semblent présenter un risque hémorragique plus élevé, notamment en cas de chirurgie ou lors de la survenue de traumatismes modérés (saignement intracrânien). Ce risque reste mal expliqué à ce jour et des études physiopathologiques sont actuellement en cours. Sur le plan biologique, le temps de saignement est allongé.
La prise en charge est essentiellement basée sur la prévention : hémostase chirurgicale soigneuse, surveillance postopératoire prolongée.
Mais chez un patient présentant une tendance hémorragique certaine, un bilan d’hémostase est nécessaire pour rechercher une anomalie de l’hémostase associée, tel un déficit en facteur Willebrand, déficit très fréquent. En l’absence d’anomalies mises en évidence, il convient de discuter lors d’une chirurgie l’utilisation de desmopressine (DDAVP – à la dose de 0,3 µg/kg dans 30 ml de sérum physiologique à passer en 30 minutes) ou d’acide tranexamique (à la dose de 20 mg/kg/j en 3 prises) pour diminuer le risque hémorragique.
- Prise en charge obstétricale des patientes atteintes d’ostéogenèse imparfaite
4.13.1 Grossesse
Pour les formes moyennes ou sévères, le suivi de grossesse et l’accouchement, doivent être réalisés au sein ou en lien avec le centre de référence/compétences maladies osseuses constitutionnelles, en maternité de type 2b ou 3 avec une structure de prise en charge adaptée pour la mère.
Pour les formes mineures, la grossesse peut être suivie dans les conditions habituelles de prise en charge.
– Consultation pré-conceptionnelle
Elle est indispensable pour les patientes présentant une forme moyenne ou sévère, et idéalement réalisée par le médecin du centre de référence et l’obstétricien qui va suivre la grossesse.
Au cours de cette consultation sera réalisé le bilan de la pathologie (radiologique si besoin), avec en particulier des épreuves fonctionnelles respiratoires en position debout et couchée afin d’évaluer quelle sera la tolérance de la fin de grossesse. Les traitements seront adaptés à la future grossesse.
– Suivi de grossesse
La tolérance de la grossesse est fonction du type et de la sévérité de la maladie, de la taille de la patiente et de sa fonction respiratoire. Elle peut également entraîner une diminution de taille de quelques centimètres.
La prise en charge spécifique comporte notamment :
- la prise en charge des douleurs : la grossesse accentue dans plus de 50 % des cas les douleurs dorso-lombaires (devant faire rechercher des tassements vertébraux par des radiographies au troisième trimestre). Elles seront améliorées par le repos et des antalgiques autorisés chez la femme enceinte ;
- dès le premier trimestre, l’utérus est intra-abdominal ce qui peut gêner la patiente notamment en cas de petite taille. De même l’utérus sera souvent anteversé en cours de grossesse en raison de la faiblesse musculaire de la paroi abdominale.
L’augmentation du volume abdominal peut entraîner la necessité d’un fauteuil roulant pour tout déplacement et une hospitalisation en fin de grossesse (sans oublier la prévention thrombo-embolique dans ce cas) ;
- dans les cas les plus sévères présentant des anomalies de bassin, le col de l’utérus peut être allongé. Cette notion est importante à connaître pour la prise en charge des fausses-couches et des interruptions médicales de grossesse chez ces patientes ;
- un suivi échographique fœtal habituel. En l’absence de réalisation du diagnostic prénatal, une échographie supplémentaire à 18 SA est conseillée ;
- une prise en charge psycho-sociale : la grossesse peut être mal vécue par les femmes porteuses d’OI en raison des limitations et des souffrances physiques induites. Un suivi psychologique doit être proposé. La fatigue physique du post-partum nécessite la mise en place d’aide à domicile ;
- une supplémentation en calcium et vitamine D : celle-ci doit être démarrée dès le début de la grossesse par des laitages abondants et de la vitamine D quotidienne (ou une ampoule de vitamine D au 3e trimestre de la grossesse).
– Accouchement
Le choix du mode d’accouchement (voie basse ou césarienne) est fonction du type et de la sévérité de la maladie. Une césarienne n‘est pas à proposer systématiquement dans les formes modérées et moyennes. Le bilan avant accouchement comporte un pelviscanner pour toutes les patientes car le bassin peut être généralement rétréci.
Dans les formes sévères, pour lesquelles une césarienne est obligatoire, l’anesthésie locorégionale est préférable à une anesthésie générale en raison des possibles difficultés d’intubation
chez certaines patientes. La péridurale ou la rachianesthésie est possible si la patiente n’a pas de matériel d’arthrodèse en regard de la zone de ponction. Dans le cas contraire, ceci peut être discuté avec un orthopédiste spécialiste du rachis.
Il est rappelé que le risque hémorragique est théoriquement supérieur, même si aucune anomalie du bilan biologique n’est retrouvée, et doit être pris en compte dans les décisions de voie d’accouchement. L’utérus est également plus fragile et les protocoles obstétricaux suivis doivent être ceux des utérus cicatriciels.
4.13.2 Diagnostic prénatal
Le couple est le plus souvent au courant du risque de transmission de 50 % pour une personne porteuse de l’affection et le souhait d’un diagnostic prénatal a été discuté.
L’ensemble de la démarche préparatoire et effective du diagnostic prénatal doit être effectué dans un centre de diagnostic prénatal agréé (liste des centres pluridisciplinaires de diagnostic prénatal disponible sur le site de la Fédération française des CPDPN : http://www.cpdpn.fr/index.php?module=Contenus&tid=2&filter=pub_c ategory^eq^841&page=1)
Une consultation avec conseiller en génétique et psychologue doit être systématiquement proposée au couple envisageant un diagnostic prénatal afin de rediscuter de la stratégie du diagnostic prénatal et de ses implications. Un suivi psychologique sera proposé tout au long de la procédure.
Si l’anomalie moléculaire est connue chez le parent porteur, le diagnostic prénatal est possible par biologie moléculaire soit sur biopsie de trophoblaste entre 11 et 12 SA, soit sur liquide amniotique lors d’une amniocentèse à partir de 16 SA. Si l’anomalie moléculaire n’est pas connue chez le parent porteur, il n’y pas de diagnostic prénatal moléculaire possible à cause du délai d’identification souvent non compatible et de l’absence de valeur pronostique de l’altération moléculaire ; seul le suivi radiologique (échographie à partir de 14-16 SA et scanner osseux 3D à partir de 28 SA) pourra mettre en
évidence des signes d’atteinte fœtale.
Le diagnostic doit être le plus précoce possible chez les patientes porteuses de formes sévères en raison des possibles difficultés techniques lors d’une IMG (interruption médicale de grossesse) décrites plus haut chez ces patientes.
Un diagnostic préimplantatoire peut être proposé dans certains cas, avec la prudence et les contraintes qu’implique cette démarche.
4.13.3 Allaitement
L’allaitement doit être discuté avec la patiente, et évité de façon prolongée. Sur une longue période, il peut être à l’origine d’asthénie, de douleurs dorsales et majorer l’ostéopénie. Il est cependant possible avec des apports calciques alimentaires maternels très encadrés.
4.14 Particularités anesthésiques
Dans les formes sévères, l’anesthésie locorégionale est préférable à une anesthésie générale en raison des possibles difficultés d’intubation chez certains patients ; quelques cas d’hyperthermie maligne ont été rapportés. La péridurale ou la rachianesthésie est possible si le patient n’a pas de matériel d’arthrodèse en regard de la zone de ponction.
- Accompagnement psychologique tout au long de la vie
4.15.1 Lors de l’annonce du diagnostic
L’annonce du diagnostic est un moment important qui peut nécessiter un accompagnement psychologique. L’annonce peut intervenir dans des conditions très différentes :
- selon l’existence ou non d’un antécédent familial connu d’OI.
Dans le cas où la pathologie apparaît de novo, il peut y avoir suspicion de maltraitance, avec parfois mise en place de mesures judiciaires, jusqu’à l’enlèvement temporaire de l’enfant du foyer familial. Il est particulièrement important d’aider les parents suspectés à tort de maltraitance. Ils peuvent rester culpabilisés et avoir des difficultés à assumer leur parentalité ;
- selon le degré de sévérité : il existe un spectre de sévérité très large, avec des répercussions variables sur la vie de la personne et de son entourage.
4.15.2 Dès l’enfance
Il faut éviter, par tous les moyens, que le caractère pessimiste ou la culpabilité de certains parents empêche l’enfant de pouvoir se projeter dans l’avenir et de trouver sa place dans la société. Il est donc nécessaire de :
- scolariser l’enfant avec les adaptations nécessaires ;
- ne pas le limiter plus qu’il est nécessaire ;
- s’il ne peut faire aucun sport, l’aider à trouver des centres d’intérêt différents : lecture, musique, dessin, maquettes, photos… ;
- éviter que l’entourage déprime autour de lui : il a un avenir, même avec de nombreuses déformations, ou dans un fauteuil roulant ;
- l’aider à trouver un emploi [renseignements au sein de la MDPH auprès de la commission des droits et de l’autonomie des personnes handicapées (CDAPH)].
- Soutien psychologique ; contact avec l’association de patients
Une prise en charge psychologique doit être proposée aux enfants mais également aux parents ou aux frères et sœurs, soit par un psychologue de proximité [centre médico-psycho-pédagogique (CMPP), psychologues libéraux], soit par un psychologue du centre de compétences le plus proche, ou par un psychologue du centre de référence.
Les contacts avec l’Association de l’Ostéogenèse Imparfaite sont aussi très importants pour les parents, comme pour les patients. Ne pas oublier de donner les coordonnées de celle-ci.
- Suivi
5.1 Objectifs
- évaluer l’évolution du patient, l’efficacité des traitements et leur tolérance, les différentes prises en charge afin de les optimiser et de les adapter ;
- diagnostiquer et prendre en charge les complications et comorbidités de la maladie ;
- évaluer et adapter l’éducation thérapeutique de la famille/du patient ;
- améliorer la qualité de vie du patient et de sa famille à tous les âges ;
- évaluer et optimiser l’intégration sociale, scolaire et professionnelle.
5.2 Professionnels impliqués
- Le suivi régulier est assuré par un médecin hospitalier spécialisé dans la prise en charge de cette maladie (pédiatre, généticien, médecin de médecine physique et de réadaptation, orthopédiste, rhumatologue), en lien avec le médecin traitant. Ce suivi peut être effectué dans le cadre de consultations pluridisciplinaires.
- Le médecin traitant (pédiatre ou médecin généraliste) :
- surveille la croissance staturale et pondérale (incluant l’indice de masse corporelle) ;
- surveille l’adhésion au traitement et s’assure de sa compréhension auprès de la famille ;
- dépiste des changements dans l’évolution du patient (survenue de douleurs, infléchissement statural, augmentation de la fréquence des fractures) et en informe le CR/CC.
Les professionnels impliqués sont identiques à ceux assurant la prise en charge (cf. chapitre 4.3).
5.3 Rythme et contenu des consultations
Le rythme des consultations spécialisées hospitalières dépend de l’âge du patient : une visite par an chez les enfants, une visite tous les trois ans à l’âge adulte. Le suivi est également adapté en fonction de la sévérité et des complications de la maladie.