Prothèses d’épaules anatomiques sans tige et avec tige. Le remplacement articulaire de l’épaule peut être total ou partiel dans le cadre des hémi-arthroplasties.
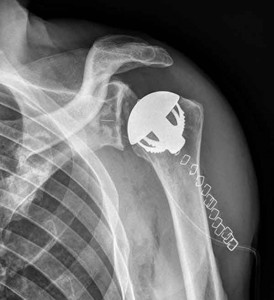
Prothèse d’épaule sans tige totale anatomique
Voici un travail réalisé en 2010 concernant le resurfaçage de l’épaule par le Docteur Richard Ballas, chirurgien orthopédiste à l’ile de La Réunion : memoire resurfaçage épaule DIU Dr Ballas
MEMOIRE
Pour l’obtention du
Diplôme Inter-Universitaire
De Pathologie de l’Epaule et du Coude
Le RESURFACAGE de l’EPAULE
Richard Ballas
Année universitaire 2009 – 2010
I Introduction
II Genèse – Evolutions
A Premiers essais
B L’expérience scandinave
C Les implants modernes
III Conception – Principes
A Principes généraux
1 Economie osseuse
2 Restauration de l’anatomie
3 Fixation sans ciment et sans tige
4 En cas de reprise
B Contraintes
C Indications
IV Un cas particulier
V Technique chirurgicale
A Voie d’abord
B Préparation de l’humérus
C Préparation de la glène
D Mise en place des implants et fermeture
VI Résultats bibliographiques
A Premiers résultats
B Jeunes patients (<55 ans)
C Polyarthrite rhumatoïde
D Ostéonécrose
E Arthrose post rupture massive de coiffe
F Luxation antérieure invertérée
G Patients âgés de plus de 80 ans
VII Synthèse personnelle et conclusion
VIII Bibliographie
I Introduction
Jules Emile Péan réalisa la première arthroplastie d’épaule en 1893 à Paris en caoutchouc et platine pour une reconstruction après résection pour tuberculose de l’épaule. Bien qu’elle due être explantée 2 ans plus tard, ce fût une réussite en considérant les conditions de l’époque
Les prothèses modernes verront le jour en 1953 par Charles S. Neer1 aux USA.
C’est à S.A. Copeland (Grande Bretagne) qui a développé un implant de resurfaçage dans les années 1980, que l’on doit la diffusion des implants modernes. Il est parti du principe que les précédents modèles étaient initialement développés pour les fractures 4 parts de l’extrémité supérieure de l’humérus, et leurs utilisations a été élargie par la suite pour l’omarthrose à partir de ce type prothétique d’origine. Alors pour des articulations peu détruites, il se pose la question de la nécessité d’une résection osseuse irréversible et de l’implantation d une tige intra-médullaire avec leurs conséquences que l’on connait : escalade thérapeutique lors des reprises pour pertes osseuses croissantes, infection plus difficile à juguler… Si une révision ou d’une arthrodèse devenait nécessaire, les opérations seraient alors plus simples grâce à la conservation du stock osseux et l’absence de perte de longueur.
Les problèmes rencontrés pour le resurfaçage de la hanche sont autres et ne peuvent pas être comparés à ceux de l’épaule (biomécanique, vascularisation), en témoignent les bons résultats du resurfaçage au niveau du genou.
II Genèse – Evolution
A Premiers essais
Parmi les premières tentatives de « soulagement articulaire » et d’arthroplasties, les interpositions articulaires (fascia) peuvent être considérées comme des techniques de resurfaçage.
La prothèse de Judet en 1947 en acrylique dont les résultats furent publiés en 1953, avait été à vrai dire plutôt un implant de resurfaçage.
Zipple en Allemagne (1975), et Steffee et Moore (1984, USA)2 s’intéressèrent au resurfaçage de l’épaule. Ces derniers utilisèrent initialement les implants de resurfaçage d’épaule puis des implants spécifiques. Randelli en Italie rapporta de bons résultats en 1990.
B L’expérience Scandinave
Le concept de resurfaçage a été beaucoup utilisé en Scandinavie pour des patients atteints de polyarthrite rhumatoïde avec la cupule SCAN. Jonsson3 a rapporté en 1986 les résultats de sa prothèse de resurfaçage Scancup chez 26 patients.
C Les implants modernes
S.A. Copeland2,4 mis au point une série d’implants dont le concept et le design furent à l’origine de la démocratisation du resurfaçage de l’épaule. Les prothèses furent développées dès 1978, implantées pour la première fois en 1986 chez un patient et commercialisée en 1988.
La prothèse Mark 1 (Mark1 prosthesis, 3M, UK), première mise au point, se composait d’une glène Mark 1 et d’une partie humérale Mark 1. La glène en polyéthylène UHMWP (Ultra-High Molecular Weight Polyethylene) était impactée en press-fit dans l’os par un plot créant une fixation primaire. Son rayon de courbure équivalait celui de la tête humérale (24,5 mm), et correspondait avec les implants de Neer permettant de l’inter-changer si l’indication per-opératoire changeait après la pose de la glène ou bien en cas de reprise unipolaire de l’humérus. L’implant huméral, en titane, contenait un plot avec une empreinte femelle pour accueillir une vis insérée à la face latérale de l’humérus, mettant la prothèse en compression (Figure 1a et 1b). Les débricolages de la vis de compression et la stabilité satisfaisante sans cet artifice ont conduit les concepteurs a abandonner la vis latérale. De plus, si l’implant venait à se desceller et à migrer, il y aurait eu un risque de fracturer et séparer les tubérosités.
Figure 1 a et 1b : Implant Mark 1 avec sa vis de compression latérale
De 1989 à 1993, l’implant Mark 25 (Zimmer, Swindon, UK) glénoïdien, tout en conservant l’épaisseur et le rayon de courbure de son prédécesseur, le remplaça avec du métal-back (Figure 2). L’embase métallique conservait un plot d’ancrage, associé à des rainures internes. Son versant huméral abandonna la vis latérale, et son ancrage primaire était assuré par un plot du même type que celui de sa glène, tous les 2 striés (6 rainures pour Mark 2a puis 4 pour l’implant Mark 2b) et plus effilés que le premier modèle. Cet implant sera par la suite fabriqué en chrome-cobalt.
Figure 2 : Implant Mark II. (Reproduite avec l’aimable autorisation du Pr Levy).
La génération Mark 3 (Biomet Merck, Swindon, UK) d’implant a été revêtue d’hydroxyapatite en 1993 afin de d’accroître la fixation secondaire des implants par intégration osseuse au-delà d’un press-fit primaire (Figure 3).
Les évolutions de cet implant a suivi celle des biomatériaux, mais son design resta le même.
Figure 3 : Implant Mark III revêtu d’hydroxyapatite
III Conception – Principes
A Principes généraux
Les aspects du resurfaçage diffèrent de l’arthroplastie non contrainte à tiges par plusieurs aspects. Le concept du design est le remplacement de seulement la surface articulaire endommagée et tente de reproduire au mieux l’anatomie normale avec des résections osseuses minimales.
Le resurfaçage est prothétique et se substitue à la surface articulaire.
Les implants développés par C.S. Neer étaient indiqués pour les fractures 4-parts de l’extrémité proximale de l’humérus. Bien que non contraintes, la tige était indispensable puisqu’elle est le bras de levier servant à vaincre les forces dues à la réinsertion des tubérosités à son autre extrémité. De ces prothèses ont suivies les implants destinés à l’omarthrose dont les résultats ont été publiés en 1974 dans un article princeps6. Grammont (France) mis au point les prothèses d’épaules inversées destinées aux arthroplasties d’épaule atteintes d’omarthroses secondaires (excentrées). Ces implants sont utilisés également pour l’omarthrose primitive, bien qu’ils n’aient pas été conçus dans ce but.
Au début des années 1980, est apparue l’idée de développer une prothèse d’épaule spécifique pour les épaules arthrosiques peu détruites en utilisant un implant de resurfaçage articulaire7.
- Economie osseuse
L’économie osseuse est partie intégrante du concept. En cas de reprise, l’opération doit pouvoir se dérouler le plus possible comme s’il s’agissait d’une chirurgie première en terme de stock osseux. L’os réséqué pour la mise en place du plot central sera réutilisé pour combler les éventuels défects osseux initiaux sous la cupule.
2 Restauration de l’anatomie
C.S. Neer propose de restaurer au mieux l’anatomie du patient. Sa restauration est facilitée puisque l’implant est positionné à la place de la surface articulaire initiale préparée. Les contraintes de version céphalique humérale, inclinaison (angle cervico-diaphysaire : varus – valgus), hauteur, offset (déports médial et postérieur de la tête humérale), centre de rotation, bras de levier trochitérien sont levés, et les valeurs initiales individuelles reproduites. L’ancillaire peut donc être plus simple et facile d’utilisation, comme le préconisent la majorité des auteurs, et notament C.S. Neer concernant la chirurgie prothétique de l’épaule. Le chirurgien a donc toute liberté de positionnement dans les 3 plans de l’espace afin de s’adapter au mieux à l’anatomie du patient. Même en cas d’usure importante, le col anatomique débarrassé de ses ostéophytes peut être visualisé et servir de base à l’implantation anatomique.
La restitution de l’anatomie permet de conserver la tension correcte des tissus mous péri-articulaires, la balance musculo-tendineuse8-10 et un bras de levier de la coiffe des rotateurs efficace8,11. Lors de la résection de la tête humérale pour mise en place d’une prothèse anatomique avec tige, il faut repositionner la tête prothétique dans la position anatomique, ce qui est plus difficile. De plus la tête prothétique est dépendante de la position de la tige dans le fût intra-médullaire, malgré les possibilités multiples apportés par les prothèses modulaires.
3 Fixation sans ciment et sans tige
La fixation est sans ciment. Le design de l’implant et son revêtement doit permettre d’obtenir une stabilité primaire par fixation mécanique en press-fit et secondaire biologique par ostéo-intégration. Le volume de corps étranger augmenté par le ciment est un facteur de risque supplémentaire d’infection.
Il n’est pas toujours possible d’introduire une tige centromédullaire en cas de distorsion de la diaphyse, de tiges d’implant de coude ou autre.
Les tiges des prothèses classiques ont leurs complications propres. En per-opératoire, leur implantation altère le spongieux métaphysaire. Il y a un risque de fausse-route, de malposition ou de fracture per-opératoire (3%)12,5. En postopératoire, on peut voir des fractures péri-prothétiques par apparition de zones d’élasticités différentes le long de la diaphyse ou des fractures propre de la tige.
4 En cas de reprise
Lors de l’ablation des implants fixés auparavant par cimentation, il y a un défect osseux supérieur à l’empreinte de la prothèse, et l’ablation du ciment n’est pas toujours sans difficultés ni conséquences. Les complications des prothèses standards à tige sont de l’ordre de 20%12,5.
L’ablation des tiges centromédullaires en chirurgie de reprise présente des difficultés et peuvent entrainer des dégâts osseux majeurs.
La perte osseuse engendrée par l’empreinte d’une tige et/ou du ciment peut être un problème ou tout du moins une difficulté supplémentaire si une arthrodèse devenait indiquée.
Le resurfaçage facilite donc les reprises par rapport aux prothèses avec tiges, et Matsen13 rappelle que les résultats des reprises chirurgicales sont décevants à l’épaule plus qu’ailleurs.
B Contraintes
La restauration de l’anatomie initiale doit tenir compte de l’érosion du cartilage, et de la médialisation du centre de rotation. Ceci a pour effet de détendre relativement les structures péri-articulaires. Si cette évolution s’est faite progressivement et sur une longue période, ces tissus s’adaptent à la nouvelle morphologie en se rétractant. La restauration de l’anatomie initiale peut alors décompenser une situation qui s’était adapter progressivement aux déformations.
Lors de la fermeture de la voie antérieure delto-pectorale, la suture du muscle subscapulaire peut s’avérer difficile et limiter la rotation externe. Cette rotation interne fixée provoque une translation postérieure et une subluxation postérieure.
La latéralisation du centre de rotation n’est donc pas toujours possible sans conséquences sur la stabilité future de l’épaule. La restauration de la latéralisation aura également des conséquences sur les muscles de la coiffe et le deltoïde en leur imposant une tension excessive.
Il y aura donc un compromis à faire entre une implantation dans la configuration « pathologique » et la restauration de l’anatomie initiale.
C Indications
Les indications initialement limitées aux omarthroses primitives peu évoluées, sont aujourd’hui étendues à près de 90% des arthroplasties pour S.A. Copeland2,14, et utilisées pratiquement pour les mêmes indications que les prothèses d’épaule anatomiques à tiges.
Il faut néanmoins une base osseuse suffisante pour la mise en place de l’implant de resurfaçage. Les auteurs estiment qu’il faut au minimum 60% de la surface articulaire humérale compétente pour permettre l’implantation de la prothèse.
Le resurfaçage huméral peut être utilisé avec ou sans resurfaçage glénoïdien (prothèse totale d’épaule ou hémi-arthroplastie).
La même contrainte de stock osseux est applicable à la glène, si l’érosion s’étend jusqu’au pied de la coracoïde, l’implant glénoïdien ne pourra pas être mis en place.
Les bons résultats de l’hémi-arthroplastie incitent à ne pas utiliser systématiquement de glène prothétique2, d’autant plus que sa mise en place lors du resurfaçage est plus difficile.
Les indications les plus évidentes sont l’arthrose primitive et les omarthroses secondaires centrées (post-instabilité, post-traumatique, ostéonécroses) chez des patients jeunes. Les autres indications relevées sont la polyarthrite rhumatoïde, l’omarthrose secondaire excentrée (rupture de coiffe, arthropathie destructrices).
IV Un cas particulier
Une des difficultés avec les implants anatomiques à tiges est la correction de l’offset postéro-médial. En effet, dans le cas des prothèses monobloc initiales, celui-ci était fixé puisque le centre de la tête était fixé sur la tige intra-médullaire, elle-même positionnée de façon très peu modifiable dans le fût intra-médullaire.
L’utilisation des prothèses modulaires modernes permet de résoudre certains de ces problèmes. Néanmoins, lors d’arthrose post-traumatique avec cals vicieux, il faut faire avec une anatomie particulièrement modifiée. La mise en place de la prothèse avec tige nécessite une ostéotomie de tubérosités (type 3 et 4 de Boileau15) pour éviter une fracture per-opératoire et pour centrer la tige dans la diaphyse. Cette ostéotomie procure de plus mauvais et imprévisibles résultats. Il faudra planifier la hauteur de la corolle afin de rétablir l’index céphalo-tubérositaire.
L’utilisation de prothèses de resurfaçage ne peut être indiquée en cas de nécrose étendue avec résorption osseuse importante de la tête humérale (>60%) car les implants ne peuvent être positionnés ou en cas de modifications anatomiques importantes et de cals vicieux.
Tout en conservant la philosophie du resurfaçage, c’est à dire de conserver un stock osseux maximal, sans utilisation de tige ni de ciment et en restaurant l’anatomie, un implant anatomique à fixation métaphysaire a été conçu en 2004. Il s’agit de la prothèse anatomique T.E.S.S.® (Total Evolutive Shoulder System) (Biomet Inc,Warsaw, IN)16,17.
Elle consiste en une fixation métaphysaire par une corolle à 6 bras avec une tête humérale fixée dessus par l’intermédiaire d’un cône morse. Afin de s’adapter au mieux à l’anatomie, plusieurs tailles de corolle (4) et de tête (6) sont disponibles. L’implant est en chrome-cobalt, avec spray titane et revêtement d’hydroxyapatite.
Un avantage qui en découle par rapport au resurfaçage, est la meilleure exposition de la glène qui est particulièrement difficile sans coupe céphalique. Il existe une glène cimentée totalement en polyéthylène et une glène sans ciment avec métal-back. (Figures 4, 5a et 5b).
Figure 4 : Implant TESS
Le groupe TESS rapporta en 2010 après 3 ans d’implantation, les premiers résultats17. 72 prothèses ont été implantées chez des patients âgés en moyenne de 65 ans. L’étiologie était principalement l’arthrose primitive et secondaire post-traumatique (60 patients), et l’ostéonécrose pour les autres. 63 implants ont été évalués à 3 ans minimum de recul (44 hémi-arthroplasties et 19 arthroplasties totales). Le score de constant à progressé de 29,6 en préopératoire contre 75 en postopératoire. L’élévation antérieure active a progressé de 96° à 145° et la rotation externe a gagné 20°, atteignant 40°.
L’examen des radiographies n’a pas révélé de signes de descellement, d’ostéolyse ni d’apparition de lignes radio-transparentes. Il n’y a pas eu de déplacement des implants.
Figure 5 : implant TESS. La prothèse (5a) et radiographie avec implant en place (5b). (Photos reproduites avec l’aimable autorisation du Dr Huguet).
V Technique chirurgicale
A Voie d’abord
2,5,18,16La voie d’abord peut être delto-pectorale ou antéro-supérieure comme décrite par Neviaser19 puis Mackenzie. L’intervalle des rotateurs est repéré et incisé. Le sous-scapulaire est désinséré selon la technique que l’on désire tout en gardant à l’esprit qu’il faudra le réinséré en fin d’intervention. La longue portion du biceps est repérée et évaluée. La ténotomie – ténodèse si nécessaire est alors réalisée à ce temps opératoire.
Les avantages de la voie d’abord antéro-supérieure pour cette chirurgie est la meilleure exposition de la glène pour son resurfaçage, l’accès aux structures postérieures, l’acromioplastie et l’accès à l’articulation acromio-claviculaire facilités. Le risque principale est la lésion du nerf axillaire, pour éviter cette complication, il ne faut s’étendre au-delà de 5 cm du bord latéral de l’acromion lors de la discision du deltoïde, ou du moins ne pas descendre au-delà de la bourse sous acromio-deltoïdienne.
B Préparation de l’humérus
Une fois l’intervalle des rotateurs repéré et incisé longitudinalement, l’épaule est luxée en haut et en avant afin d’exposer la tête humérale (manœuvre d’adduction et rotation externe). (Figure 6).
Puis le col anatomique doit être clairement identifié. Pour cela, il est primordial de le débarrasser de ses ostéophytes. Sa partie supérieure et antérieure est la première à se présentée, puis le bras positionné en rotation externe, l’accès à sa partie inférieure devient possible. Il s’agit là d’un temps opératoire essentiel, car du col anatomique, dépend la position de l’implant future. De plus, les ostéophytes positionnés sous le muscle sous-scapulaire entrainent un effet de chevalet et limitent la rotation externe. Ensuite, ce release par ablation des ostéophytes donne un meilleur accès à la partie postérieure et supérieure du col anatomique. Lors de la résection des ostéophytes inférieurs, il faut être vigilant à ne pas léser le nerf axillaire.
Le guide huméral est positionné sur la tête humérale, son bord libre périphérique étant parallèle aux bords du col anatomique (Figure 6A). Une broche de Kirshner est placée à travers le guide mèche puis perfore la tête humérale jusqu’à la corticale humérale latérale afin de se stabiliser. Avant le perçage, pendant, et après l’ablation du guide huméral, le positionnement de la broche est controlée par rapport à l’axe de la diaphyse humérale et la position de l’avant-bras fléchi à 90° (en valgus de 10° par rapport au bras). La version et l’inclinaison sont alors contrôlées et peuvent être ajustées. Cependant, le concept du resurfaçage articulaire comme exposé ci-après, pousse à reproduire l’anatomie du patient, et à ne pas modifier ces paramètres. Cette position anatomique de la broche est centrale au niveau de la tête humérale.
Le trou central pour la mise en place du plot est réalisé sur la broche-guide (Figure 6B). Les débris osseux sont récupérés afin de pouvoir réaliser une autogreffe en modelant la tête humérale. Une fraise est utilisée pour modeler la tête humérale en prenant l’axe de rotation du plot central (Figure 6C). La profondeur de fraisage est de 3 mm, l’os adjacent à l’implant doit affleurer la fraise qui correspond au gabarit de l’implant définitif. L’érosion moyenne généralement constatée est de 6mm. Cette érosion cartilagineuse et osseuse, humérale et glénoïdienne, doit-être compensée soit par l’humérus en cas d’hémi-arthroplastie, soit sur les 2 composants en cas d’arthroplastie totale. L’implant huméral d’essai est alors inséré, l’articulation réduite et testée si l’opération consiste en une hémi-arthroplastie (Figure 6D).
C Préparation de la glène
En cas de prothèse totale d’épaule, la tête humérale est subluxée en bas et en arrière. L’implant d’essai est laissé en place afin de ne pas abimée l’os sous-chondral servant de base à l’implant définitif.
L’absence de coupes osseuses rend l’exposition de la glène plus difficile que lors de sa préparation pour mise en place d’une prothèse standard avec ostéotomies humérales. Pour avoir plus de jour, une capsulotomie est réalisée en antérieur, inférieur et postérieur au niveau du col glénoïdien. (Figure 6).
Un guide est placé sur la glène afin d’introduire en son centre une broche de Kirschner, après repérage de son axe (Figure 6E). En effet, les déformations et érosions asymétriques arthrosiques peuvent faire que l’axe n’est pas obligatoirement orthogonal au plan de la glène. Un trou central pour accueillir le plot est réalisé sur la broche-guide, l’os prélevé est récupéré (Figure 6F).
Enfin la glène est préparée par une fraise centrée sur le plot (Figure 6G). L’implant glénoïdien d’essai est mis en place (Figure 6H), l’épaule est réduite et la stabilité et la mobilité articulaire sont évaluées.
Il faut noter que la mise en place de la glène est un temps chirurgical particulièrement difficile car en l’absence d’ostéotomies humérales, l’accès est réduit.
Figure 6 (A,B,C,D,E,F,G,H) : Détails des étapes de la technique chirurgicale
D Mise en place des implants et fermeture
L’os sclérotique préparé doit être perforé avant la mise en place des implants définitifs. En effet, l’apparition d’un saignement au niveau de la surface d’implantation permettra la croissance osseuse pour la fixation secondaire biologique sur l’hydroxyapatite.
L’os réservé précédemment est inséré dans les zones de défect et sous la cupule céphalique pour compenser l’usure. Dans les indications d’arthrose, les géodes sont curetées et comblées par l’os enlevé ou par les ostéophytes réséqués. L’articulation est réduite et la stabilité et la mobilité sont à nouveau testées (Figure 7).
En cas d’hémi-arthroplastie, les auteurs réalisent fréquemment de multiples perforations au niveau de la surface articulaire de la glène afin de favoriser l’apparition d’une surface fibreuse.
Le sous-scapulaire est réinséré selon la méthode choisie, et selon la nécessité, allongé ou médialisé. L’intervalle de la coiffe des rotateurs est fermé
La coiffe a auparavant été explorée et si besoin (et si possible), réparée.
20
Figure 7 : Profil axillaire d’épaule montrant un implant de resurfaçage en place
VI Résultats
A Premiers Résultats
1 Levy et Copeland5 rapportent en 2001, les résultats de 103 prothèses Mark II chez 94 patients à 5 à 10 ans de recul (moyenne 6,8 années). L’age moyen était 64,3 ans ; les étiologies étaient l’arthrose (41), la polyarthrite rhumatoïde (41), nécrose (4), l’instabilité post-traumatique (5) et l’arthrose par rupture massive de coiffe (8).
Le résultat global sur le score de Constant est un gain de 51%, (24 à 75%).
Bien que les meilleurs résultats étaient observés pour l’arthrose primitive en arthroplastie totale (TSR : 94%,) et hémi-arthroplastie (HA : 74%), les gains en terme de score de Constant sont équivalents entre les étiologies, de +45 à + 60% (meilleurs pour nécrose, polyarthrite rhumatoïde en TSR et arthrose en TSR). Les plus mauvais résultats (60%) étaient retrouvés pour les arthroses post-traumatiques et par rupture massive de coiffe.
L’élévation antérieure active (EAA) globale passa de 56° à 110° avec les meilleurs résultats pour l’arthrose primitive (130°), et équivalence des TSR ou HA. La rotation externe augmenta de 8° à 50° globalement. Ces résultats sont comparables aux différentes études rapportées dans l’article concernant les prothèses à tiges.
70% des patients ne présentaient aucun liseré péri-prothétique et 2 patients (2,2%) un liseré évolutif supérieur à 2mm et un descellement. Néanmoins depuis l’évolution des implants avec un revêtement d’hydroxyapatite (Mark III), les auteurs ne retrouvent plus de liseré péri-prothétique.
8 patients ont nécessité une révision. Une infection et une instabilité ont bénéficié d’une arthrodèse (la conservation du capital osseux a permis de ne pas perdre de longueur, et la fusion s’est faite rapidement). Parmi les 6 autres révisions, 4 étaient dues à un problème glénoïdien (2 descellements, un mauvais positionnement et une dislocation du polyéthylène sur le métal-back), et un descellement bipolaire. La dernière révision était causée par une fracture humérale (col anatomique) suite à un traumatisme.
Parmi les 4 révisions pour problème glénoïdien unique, la cupule humérale a du être enlevée pour accéder à la glène, et a pu être conservée une seule fois. La révision s’est donc faite 5 fois par une prothèse standard à tige sans difficultés particulières.
Ceci représente un taux de survie de 92% à 6,8 années de recul en moyenne (5 à 10 ans), avec 94% de patients qui considèrent que leur épaule est améliorée par l’opération. Les reprises ont été effectuées facilement et rapidement. Il n’y a pas eu de complications per-opératoires à type de fracture. Les résultats rapportés sont équivalents à ceux des prothèses à tige.
Bien qu’au début de l’étude, l’utilisation d’un implant glénoïdien était la règle, actuellement, elle est resurfacée uniquement en cas de coiffe intacte et une glène non concentrique.
2 Les mêmes auteurs12 rapportèrent les résultats de leur implant pour arthrose primitive de l’épaule en 2004. 79 implants furent implantés de 1986 à 1997 (42TSR, 37 HA) utilisant les implants de Mark I à III. Le recul moyen était de 7,6 ans pour les TSR et 4,4 pour les HA.
Le score de Constant préopératoire était de 34% pour les TSR et 40% pour les HA, en postopératoire il était de 94% et 91% respectivement. L’EAA est passée de 62° à 128° pour les TSR et de 72° à 124° pour les HA. La rotation externe a gagné 40°, augmentant de 13° à 55°.
Il y a eu 1 seul implant qui présentait un liseré évolutif de plus de 2mm (TSR).
La série a présentée 4 révisions (5%), toutes dues à un problème glénoïdien : une mauvaise version, une dissociation du métal-back, un descellement idiopathique et un descellement post-traumatique. Néanmoins, l’implant huméral a du être enlevé 3 fois pour avoir un accès correct à la glène. Une prothèse à tige standard a été réimplantée dans ces cas.
Aucun implant Mark III (avec revêtement d’hydroxyapatite) n’a été révisé, et aucun liseré n’a été identifié. Néanmoins, la signification de ces liserés n’est pas démontré.
89,9% des patients considéraient leur épaule améliorée après l’opération.
Tous ces résultats sont superposables à ceux de la précédente étude pour l’arthrose primitive, et comparables aux prothèses à tige standard des différentes séries.
A la différence de leurs résultats précédents, il n’y a pas de différence entre TSR et HA. Relevant que les complications et reprises étaient principalement dues à la glène, il propose de pratiquer des hémi-arthroplasties sauf en cas d indications spécifiques à un resurfaçage glénoïdien (usure non concentrique, en selle).
B Jeunes patients (<55 ans)
3 Bailie20 en 2008, rapporta les résultats de 36 arthroplasties de resurfacage (Mark II de Copeland) pour arthrose uniquement chez des patients âgés de moins de 55 ans (âge moyen de 42 ans). Le suivi était supérieur à 2 ans (38 mois en moyenne). Il s’agissait d’arthrose primitive pour 23 patients, ou secondaire centrée (post-traumatique : 3 ; post-instabilité : 7 ; chondrolyse post-chirurgicale : 3). Il n’y a eu aucun descellement au cours du suivi, et une reprise par prothèse standard à tige pour douleur persistante à 24 mois postopératoire qui n’a pas été amélioré par le changement d’implant.
4 Lee21 (Singapour, 2009) a décrit sa série de 21 jeunes patients (age moyen 55 ans (35 – 68)) avec un recul de 4,8 années, qui ont bénéficiés d’un resurfaçage par l’implant Mark III et resurfaçage glénoïdien biologique. L’étiologie était l’arthrose primitive pour 19 patients, l’arthrose post-instabilité chez 2 patients et la polyarthrite rhumatoïde pour le dernier. Le score de Constant postopératoire était de 83,9% avec 94% de patients améliorés, l’EAA 130° (100 à 160°) et la rotation externe 39° (20 à 60°). Il y a eu 2 révisions : une pour infection et une pour totalisation. Il n’y a pas eu de descellement ni liseré radiologiques.
5 Raiss22 a également publié en 2010 (Allemagne) les résultats de 26 resurfaçages chez 23 patients de moins de 55 ans avec un suivi moyen de 2,5 ans (arthrose primitive pour 7 patients, post-traumatique pour 10 et 6 ostéonécroses. Le score de Constant augmenta de 38 à 70%. Il y a eu une reprise pour totalisation après érosion de la glène.
C Polyarthrite rhumatoïde
6 Alund23 (Suède, 2000) a revu a 4,4 ans en moyenne une série de 33 patients atteints de polyarthrite rhumatoïde. 25% de ces patients avaient des signes radiographiques de descellement. Ces résultats préliminaires satisfaisaient les patients malgré un résultat peu fonctionnel.
7 Levy et Copeland24 (2004) ont publiés les résultats de 75 resurfaçages (32 hémi-arthroplasties (HA) et 42 arthroplasties totales (TSR)). Pour polyarthrite rhumatoïde à un recul moyen de 6,5 ans. Le score de Constant a augmenté de 20% à 71% pour les HA et de 9% à 76% pour les TSR. 96% des patients se disaient améliorés. L’EAA est passé de 49° à 103° et la rotation externe de 6° à 46° en moyenne sans différences entre les groupes HA et TSR. 82% des résultats radiologiques ne montraient pas de liserés, et un seul implant avait des signes évidents de descellement. Les autres ne montraient que des liserés <1mm, et ceux-ci ne concernaient pas les implants revêtus d’hydroxyapatite. Il y a eu 3 révisions d’implants, 2 pour descellement bipolaire et un pour totalisation à cause douleurs persistantes. Ces résultats sont comparables à ceux des implants à tige.
D Ostéonécrose
8 Concernant l’ostéonécrose, Uribe25 (USA, Floride) a publié en 2009 une série prospective de 12 resurfaçages pour stades avancés d’ostéonécrose (HémiCAP, Arthrosurface). Cet implant ne remplace que la partie anormale du cartilage. Les patients étaient âgés en moyenne de 56 ans et le recul moyen était de 30 mois. L’EAA est passée de 94° en préopératoire à 142°, la rotation externe de 28 à 46° en postopératoire et le score de constant de 23 à 62.
Les radiographies n’ont pas mis en évidence de liseré et il n’y a pas eu de descellement d’implant.
9 Raiss26 (Allemagne, 2009), a rapporté 17 resurfaçages post ostéonécrose (8 post-traumatiques et 9 non traumatiques) avec un suivi moyen de 3 ans. L’implant de Copeland a été utilisé au début de l’étude puis a été remplacé par l’implant EPOCA RH Cup (Agromedical) Le score de Constant a augmenté significativement de 34% à 75 %, l’EAA de 87° à 139° et RE de 2° à 7°. Il n’y a pas eu de révision d’implant, ni de signes radiologiques d’ostéolyse. La nécrose occupait 18,6% de la surface articulaire en moyenne (9% à 31%). Les résultats étaient significativement supérieurs en postopératoire pour les nécroses non traumatiques concernant le score de Constant, l’abduction et la force. (Figures 8a, 8b, 9a, 9c).
Figures 8a et 8b : Radiographies préopératoire et postopératoire pour ostéonécrose post-traumatique et cal vicieux des tubérosités (55 ans), avec 18 mois auparavant fixation interne à foyer ouvert.
Figures 9a et 9b : Radiographies préopératoire et postopératoire pour ostéonécrose non traumatique (post corticothérapie), 41 ans.
E Arthrose post rupture massive de coiffe
10 Jerosch27 (Allemagne, 2008) a publié une série prospective de 25 patients (âge moyen de 69 ans) atteint d’arthrose avec rupture massive de coiffe des rotateurs mais avec un tendon du subscapulaire intact, en utilisant l’implant de Copeland. Leur suivi (26 mois en moyenne) a montré une augmentation du score de Constant de 14 à 53 points avec 83% de patients qui déclaraient avoir été améliorés par l’opération. Les auteurs ne notèrent pas de complications per ou postopératoires. En cas d’échec, la révision par un implant inversé pourra être effectuer puisqu’il n’y a pas de déficit osseux.
11 Shrivastava28 (USA, Floride, 2009) annonce des résultats préliminaires encourageants en hémi-arthroplasties.
F Luxation antérieure invetérée
12 Raiss29 (Allemagne, 2009) a suivi 10 patients présentant une luxation antérieure invétérée de l’épaule avec un recul moyen de 24 mois. Il y a eu 2 révisions, une pour érosion glénoïdienne et une pour récidive de luxation. Il n’y a pas eu de signes cliniques ou radiologiques de descellement. Le score de constant était passé de 20 à 61 points en postopératoire.
G Patients âgés de plus de 80 ans
13 Mullet et Copeland30 (Grande-Bretagne, 2007) rapportent les résultats prospectifs de l’implant Copeland Mark III chez 29 personnes de plus de 80 ans (âge moyen de 84 ans) avec un suivi moyen de 4,5 ans. Il s’agissait d’épaules atteintes d’arthrose primitive (17), d’arthrose post rupture massive de coiffe (9), de polyarthrite rhumatoïde (2), et d’ostéonécrose (1). Il a été pratiqué 22 hémi-arthroplasties et 7 arthroplasties totales, cependant l’évaluation n’a porté que sur 21 patients (17 arthroses primitives et 4 arthroses post rupture massive de coiffe). Le score de Constant est passé de 15% à 77%, avec 84% de patients se disant améliorés par la chirurgie. L’EAA a progressé de 49° à 106° en moyenne. Un patient a nécessité une reprise pour mise en place d’un implant inversé. Il s’agissait d’un patient atteint d’arthrose post-rupture totale de coiffe qui avait conservé des douleurs et une mauvaise fonction de l’épaule. Les complications rencontrées sont dans les mêmes proportions que chez les patients plus jeunes. Il y a un intérêt particulier à ne pas mettre de tige intra-médullaire chez ces patients en état général fragile (embolies graisseuses, temps d’anesthésie plus court) et avec un os ostéoporotique particulièrement sujet aux fractures peropératoires et postopératoires péri-prothétiques.
H Autres résultats
14 Thomas31 (2005) a décrit une série de 56 épaules (âge moyen = 68 ans) avec un suivi moyen de 34 mois. Ils ont bénéficiés d’hémi-arthroplasties par l’implant de Copeland Mark III. Le diagnostique pré-opératoire était l’arthrose primitive (20), polyarthrite rhumatoïde (26), l’arthrose post-traumatique (1) et post-rupture massive de coiffe (1). Le score de Constant est passé de 16 à 54. L’EAA de 65° à 108° (120 pour le groupe arthrose et 97 pour le groupe PR), la rotation externe de 6° à 43°. Il y eu une fracture per-opératoire de la glène lors de la luxation, une fracture du col huméral post-chute (traitée orthopédiquement) et 3 signes d’ostéolyse radiographique : une a été révisée pour descellement aseptique et les deux autres étaient asymptomatique et radiologiquement non progressives.
Figure 10 : Descellement aseptique de l’implant Copeland Mark III. (License de reproduction CCC N° 2436021358648).
15 Ohl32 (France, Reims) en 2010 a publié les résultats de 13 resurfaçages parmi 19 arthroplasties (6 Mark de Copeland, et 7 Global Cap, Depuy) pour arthrose (6) ou ostéonécrose (7) en hémi-arthroplastie afin d’évaluée l’usure glénoïdienne et sa répercussion clinique. Les patients étaient âgés de 55 ans en moyenne et ont tous été revus à plus de 2 ans (46 mois en moyenne). Le score de Constant postopératoire était de 76% (75% pour les prothèses à tige). L’EAA globale est passée de 106° à 153° en postopératoire (136° à la dernière revue), et la rotation externe de 30° à 46° au dernier suivi.
16 Buchner33 (Allemagne, 2008) à comparé le resurfaçage (CSRA) avec l’arthroplastie totale (TSR) d’épaule. Deux groupes de 22 patients ont été appariés (61 ans en moyenne, atteint d’arthrose primitive). Les résultats péri-opératoires des patients ayant bénéficiés d’un resurfaçages avaient des résultats significativement meilleurs (durée opératoire, saignement, durée d’hospitalisation). Bien qu’il y eût une tendance meilleure des résultats du groupe d’arthroplastie totale, ils n’étaient significatifs que pour la mobilité et l’abduction. A un an postopératoire, le bénéfice en terme de score de Constant était significativement meilleur pour le groupe TSR et en mobilité.
VII Synthèse personnelle et Conclusion
Bien qu’utilisé initialement comme arthroplastie totale d’épaule, le resurfaçage a montré son bénéfice utilisé en hémi-arthroplastie.
Les différents auteurs s’accordent à ne resurfacer la glène qu’en cas d’usure non concentrique de glène ou dysplasique (stades B1, B2 et C de Walch) et avec une coiffe compétente. En effet, les résultats semblent similaires en cas d’hémi-arthroplasties qu’en cas d’arthroplasties totales. De plus l’accès à la glène est rendue difficile par l’absence de coupes osseuses humérales. Enfin, les complications sont pour la plupart dues à un problème d’implant glénoïdien.
Il semble nécessaire d’avoir au minimum 60% du capital céphalique persistant pour pouvoir implanté la cupule de resurfaçage dans de bonnes conditions.
Peu de ces séries ont un recul nettement supérieur à deux années, il s’agit pour la plupart de données à court ou moyen terme.
Les durées opératoires rapportées dans les différentes études sont de 25 à 60 minutes.
Les révisions, lorsqu’elles ont été nécessaires se sont faites sans difficultés particulières
L’arthrose post instabilité n’a pas été évaluée dans ces publications. L’évolution naturelle de l’instabilité se fait rarement vers l’arthrose. L’arthrose post-instabilité est donc fréquemment de cause iatrogénique : choix thérapeutique inadapté et conflits de matériels implantés lors de gestes de stabilisation (vis, agrafes). Il semble que ce soit une des indications de choix chez ces jeunes patients à la demande fonctionnelle importante.
Le resurfaçage d’épaule a montré des résultats presque similaires aux implants standards à tige que ce soit en hémi-arthroplastie ou en arthroplastie totale. Les reprises potentiellement nécessaires chez les patients jeunes font qu’il s’agit d’une possibilité thérapeutique qu’il ne faut pas négliger.
VIII Bibliographie
- NEER, C.S. Articular replacement for the humeral head. J Bone Joint Surg Am 37-A, 215-228 (1955).
- Mansat, M. Prothèses d’épaule. (Elsevier Masson: 1999).
- Jónsson, E., Egund, N., Kelly, I., Rydholm, U. & Lidgren, L. Cup arthroplasty of the rheumatoid shoulder. Acta Orthop Scand 57, 542-546 (1986).
- Mansat, P. Le resurfaçage de l’épaule. (Sauramps Médical: 2009).
- Levy, O. & Copeland, S.A. Cementless surface replacement arthroplasty of the shoulder. 5- to 10-year results with the Copeland mark-2 prosthesis. J Bone Joint Surg Br 83, 213-221 (2001).
- Neer, C.S. Replacement arthroplasty for glenohumeral osteoarthritis. J Bone Joint Surg Am 56, 1-13 (1974).
- Jónsson, E., Egund, N., Kelly, I., Rydholm, U. & Lidgren, L. Cup arthroplasty of the rheumatoid shoulder. Acta Orthop Scand 57, 542-546 (1986).
- Harryman, D.T., Sidles, J.A., Harris, S.L., Lippitt, S.B. & Matsen, F.A. The effect of articular conformity and the size of the humeral head component on laxity and motion after glenohumeral arthroplasty. A study in cadavera. J Bone Joint Surg Am 77, 555-563 (1995).
- Pearl, M.L. & Volk, A.G. Retroversion of the proximal humerus in relationship to prosthetic replacement arthroplasty. J Shoulder Elbow Surg 4, 286-289 (1995).
- Jobe, C.M. & Iannotti, J.P. Limits imposed on glenohumeral motion by joint geometry. J Shoulder Elbow Surg 4, 281-285 (1995).
- Fischer, L.P., Carret, J.P., Gonon, G.P. & Dimnet, J. [Cinematic study of the movements of the scapulo-humeral (articulatio humeri) joint]. Rev Chir Orthop Reparatrice Appar Mot 63 Suppl 2, 108-115 (1977).
- Levy, O. & Copeland, S.A. Cementless surface replacement arthroplasty (Copeland CSRA) for osteoarthritis of the shoulder. J Shoulder Elbow Surg 13, 266-271 (2004).
- Duparc, J. & Collectif Conférences d’enseignement 2005. (Elsevier Masson: 2005).
- Levy, O. & Copeland, S.A. Cementless surface replacement arthroplasty (Copeland CSRA) for osteoarthritis of the shoulder. J Shoulder Elbow Surg 13, 266-271 (2004).
- Walch, G. & Boileau, P. Shoulder arthroplasty. (Springer: 1999).
- Mansat, P. Le resurfaçage de l’épaule. (Sauramps Médical: 2009).
- Huguet, D., Declercq, G., Rio, B., Teissier, J. & Zipoli, B. Results of a new stemless shoulder prosthesis: Radiologic proof of maintained fixation and stability after a minimum of three years’ follow-up. J Shoulder Elbow Surg (2010).doi:10.1016/j.jse.2009.12.009
- Copeland, S., Benjamin, A. & Birch, R. Operative shoulder surgery. (Churchill Livingstone: 1995).
- Neviaser, R.J. & Neviaser, T.J. Lesions of musculotendinous cuff of shoulder: diagnosis and management. Instr Course Lect 30, 239-257 (1981).
- Bailie, D.S., Llinas, P.J. & Ellenbecker, T.S. Cementless humeral resurfacing arthroplasty in active patients less than fifty-five years of age. J Bone Joint Surg Am 90, 110-117 (2008).
- Lee, K.T., Bell, S. & Salmon, J. Cementless surface replacement arthroplasty of the shoulder with biologic resurfacing of the glenoid. J Shoulder Elbow Surg 18, 915-919 (2009).
- Raiss, P., Pape, G., Becker, S., Rickert, M. & Loew, M. [Cementless humeral surface replacement arthroplasty in patients less than 55 years of age]. Orthopade 39, 201-208 (2010).
- Alund, M., Hoe-Hansen, C., Tillander, B., Hedén, B.A. & Norlin, R. Outcome after cup hemiarthroplasty in the rheumatoid shoulder: a retrospective evaluation of 39 patients followed for 2-6 years. Acta Orthop Scand 71, 180-184 (2000).
- Levy, O., Funk, L., Sforza, G. & Copeland, S.A. Copeland surface replacement arthroplasty of the shoulder in rheumatoid arthritis. J Bone Joint Surg Am 86-A, 512-518 (2004).
- Uribe, J.W. & Botto-van Bemden, A. Partial humeral head resurfacing for osteonecrosis. J Shoulder Elbow Surg 18, 711-716 (2009).
- Raiss, P. et al. Treatment of osteonecrosis of the humeral head with cementless surface replacement arthroplasty. J Bone Joint Surg Am 91, 340-349 (2009).
- Jerosch, J., Schunck, J. & Morsy, M.G. [Shoulder resurfacing in patients with rotator cuff arthropathy and remaining subscapularis function]. Z Orthop Unfall 146, 206-210 (2008).
- Shrivastava, N. & Szabo, R.M. Copeland EAS hemi-resurfacing arthroplasty for rotator cuff tear arthropathy: preliminary results. J Surg Orthop Adv 18, 189-194 (2009).
- Raiss, P., Aldinger, P.R., Kasten, P., Rickert, M. & Loew, M. Humeral head resurfacing for fixed anterior glenohumeral dislocation. Int Orthop 33, 451-456 (2009).
- Mullett, H. et al. Copeland surface replacement of the shoulder. Results of an hydroxyapatite-coated cementless implant in patients over 80 years of age. J Bone Joint Surg Br 89, 1466-1469 (2007).
- Thomas, S.R., Wilson, A.J., Chambler, A., Harding, I. & Thomas, M. Outcome of Copeland surface replacement shoulder arthroplasty. J Shoulder Elbow Surg 14, 485-491 (2005).
- Ohl, X., Nérot, C., Saddiki, R. & Dehoux, E. Shoulder hemi arthroplasty radiological and clinical outcomes at more than two years follow-up. Orthop Traumatol Surg Res 96, 208-215 (2010).
- Buchner, M., Eschbach, N. & Loew, M. Comparison of the short-term functional results after surface replacement and total shoulder arthroplasty for osteoarthritis of the shoulder: a matched-pair analysis. Arch Orthop Trauma Surg 128, 347-354 (2008).